6 Minute
Cercetătorii au identificat o clasă specializată de celule imunitare CD4 care recunosc și elimină celulele senescente — așa-numitele celule „zombie” care se acumulează odată cu înaintarea în vârstă și promovează inflamația cronică. Descoperirea, condusă de Universitatea Ben-Gurion din Negev, sugerează că sistemul imunitar se adaptează la procesul de îmbătrânire prin generarea unor efectori țintiți care limitează deteriorarea tisulară și mențin homeostazia.
Cum se adaptează sistemul imunitar la îmbătrânire
Celulele care intră în stare de senescență încetează să se dividă, dar continuă să elibereze molecule proinflamatorii și factori de secretie care modifică microambientul local. De-a lungul anilor, acest proces — numit senescență celulară — contribuie la fibroză tisulară, disfuncție de organ și la o inflamație cronică de grad scăzut, frecvent denumită „inflammaging”. Componentele secreției asociate senescenței (SASP) includ citokine, chimokine, proteaze și factori profibrotici care promovează deteriorarea țesuturilor și atrag celule imunitare. Deși comunitatea științifică a presupus de mult că sistemul imunitar are un rol în eliminarea acestor celule dăunătoare, participanții exacți și mecanismele precise au rămas parțial neclare.
Studiul recent identifică celulele CD4‑Eomes, o variantă a limfocitelor T helper care exprimă proteina de transcripție Eomesodermin (Eomes), drept o linie frontală de apărare împotriva celulelor senescente. Prin compararea profilurilor imune obținute din șoareci tineri și vârstnici, echipa a observat două tipare esențiale: prezența celulelor senescente determină limfocitele T CD4 să adopte fenotipul CD4‑Eomes, iar animalele modificate genetic pentru a nu putea dezvolta această specializare au acumulat mai multe celule senescente. Pe scurt, celulele CD4‑Eomes par a fi un răspuns adaptativ la sarcina crescută de celule senescente care apare odată cu înaintarea în vârstă, reprezentând un mecanism de supraveghere imună specifică.
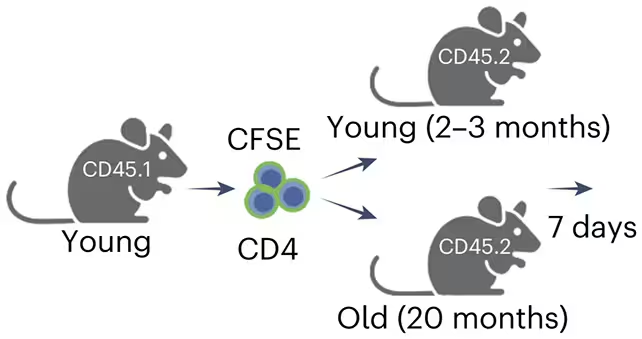
Dovezi din experimente și modele de boală
Pentru a testa funcția acestor celule, cercetătorii au efectuat transfer adoptiv de limfocite T CD4 prelevate de la animale tinere în receptori atât tineri, cât și îmbătrâniți, și au monitorizat rezultatele pe termen scurt și mediu. În cazurile în care erau disponibile specializări CD4‑Eomes, numărul de celule senescente a scăzut semnificativ, iar biomarkerii asociați leziunii tisulare și ai inflamației cronice s-au ameliorat. Efectul protector nu s‑a limitat la teste de laborator: într-un model murin de ciroză hepatică, prezența celulelor CD4‑Eomes a redus formarea de țesut fibrotic, a limitat severitatea cicatrizării și a scăzut nivelul celulelor senescente din parenchimul hepatic afectat.
Aceste experimente oferă dovezi funcționale directe că celulele CD4‑Eomes contribuie la controlul populațiilor de celule senescente. Atunci când această specializare imună a fost eliminată genetic, celulele senescente au proliferat și au persistat în țesuturi, consolidând ideea că acest subset imun este esențial pentru întreținerea țesuturilor pe măsură ce organismele îmbătrânesc. Dintr-o perspectivă mecanistică, datele sugerează că CD4‑Eomes pot recunoaște semnale specifice SASP sau antigene modificate exprimate de celulele senescente, activând răspunsuri citotoxice sau ajutând la recrutarea altor efectori imunitari.
De ce contează pentru cercetarea anti‑îmbătrânire
Multe strategii de rejuvenare pornesc de la ipoteza că resetarea unui sistem imunitar îmbătrânit către un profil „tânăr” ar reprezenta cheia inversării declinului legat de vârstă. Studiul echipei de la Ben‑Gurion avertizează însă împotriva unei strategii uniforme. Un profil imun care include celule CD4‑Eomes poate fi, de fapt, benefic la adulții în vârstă, iar „ștergerea” completă a acestui profil pentru a recrea un profil imun juvenil ar putea elimina apărarea adaptativă utilă, mărind riscul acumulării celulelor senescente și al afectării tisulare. În termeni practici, intervențiile imunologice care nu țin cont de aceste adaptări ar putea fi ineficiente sau chiar dăunătoare.
Investigatori principali recomandă că obiectivul terapeutic nu ar trebui să fie un sistem imunitar hiperactiv artificial, ci unul calibrat corect în funcție de stadiul de viață al individului — capabil să elimine în mod eficace celulele senescente fără a declanșa inflamație autoimună sau reacții off‑target dăunătoare. Aceasta implică o abordare precisă, bazată pe biomarkeri, pentru a determina când și cum să potențăm răspunsurile CD4‑Eomes sau alte componente ale imunității care promovează homeostaza tisulară.
Următorii pași și perspective tranziționale
Rămân întrebări cheie: generează și sistemul imunitar uman celule CD4‑Eomes în mod similar cu cel murin și, dacă da, în ce măsură sunt influențate de factori precum genetica, mediul, istoricul de boli și expunerile inflamatorii anterioare? Echipa de cercetare intenționează să cartografieze răspunsurile CD4‑Eomes în țesuturi umane, inclusiv probe de sânge periferic, țesuturi din biopsii și modele ex vivo, pentru a înțelege distribuția, funcția și potențialele markeri de activitate ale acestor celule. Un obiectiv imediat este identificarea unui set de markeri fenotipici și transcriptomici care să permită detectarea fiabilă a CD4‑Eomes în probe umane.
Dacă pot fi dezvoltate terapii care să amplifice în siguranță funcția CD4‑Eomes, ele ar putea completa strategiile existente, precum medicamentele senolitice care elimină selectiv celulele senescente sau terapiile imunomodulatoare ce reglează răspunsurile inflamatorii. Posibile abordări includ stimularea specifică a expansiunii CD4‑Eomes prin vaccinuri terapeutice, adoptive transfer de celule autologe ex‑vivo îmbunătățite, sau mici molecule care favorizează diferențierea către fenotipul Eomes pozitiv. Totuși, cercetătorii subliniază prudența: translatarea rezultatelor de la șoareci la oameni necesită validări riguroase pentru a evita efectele imune off‑target, cum ar fi autoimunitatea sau inflamația cronică accentuată.
Pe termen lung, integrarea strategiilor ce vizează celulele senescente — de exemplu combinația de agenți senolitici cu potențarea răspunsului CD4‑Eomes — ar putea oferi un control mai durabil al sarcinii senescente, reducând inflamația sistemică, îmbunătățind funcția organelor și atenuând riscul de boli legate de vârstă, inclusiv fibroză, insuficiență de organ și anumite tipuri de cancer. Acest tip de terapie combinatorie ar necesita studii clinice etapizate și biomarkeri clar definiți pentru a monitoriza eficacitatea și siguranța.
Pentru moment, descoperirea poziționează îmbătrânirea ca un joc dinamic între deteriorarea celulară acumulată și adaptarea imună, deschizând o nouă direcție de cercetare care leagă senescența celulară, inflamația cronică și specializarea imunitară. Aceasta pune în relief importanța înțelegerii răspunsurilor imune specifice la nivel celular pentru a dezvolta intervenții anti‑îmbătrânire care să fie atât eficiente, cât și sigure.
Sursa: sciencealert

Lasă un Comentariu