10 Minute
Cercetătorii au identificat o variantă a unui singur gen care provoacă o formă extrem de rară de diabet la nou-născuți — o descoperire care aduce lumină asupra mecanismelor prin care celulele beta producătoare de insulină se dezvoltă și eșuează. Această mutație compromite funcția celulelor beta și poate conduce la moartea lor, oferind o explicație pentru trio-ul simptomatic îngrijorător observat la sugarii afectați: diabetul neonatal, microcefalia și convulsiile. Înțelegerea acestei legături genetice și cellulare este esențială pentru diagnosticul genetic, consilierea familială și dezvoltarea de strategii terapeutice care vizează conservarea sau înlocuirea celulelor beta. Pe măsură ce studiile pe modele de celule stem pluripotente umane și pe modele murine avansează, se conturează oportunități atât pentru cercetarea fundamentală, cât și pentru abordări clinice viitoare în domeniul diabetului, incluzând medicamente care reduc stresul reticulului endoplasmatic și strategii de terapie celulară.
Un singur gen, un sindrom devastator al copilăriei
O echipă internațională de cercetare a urmărit cazurile de diabet neonatal la șase sugari până la mutații în gena TMEM167A. Acești bebeluși prezentau, de asemenea, microcefalie (mărimea anormal de mică a capului) și, în cinci din cele șase cazuri, epilepsie — o constelație de semne deja recunoscută sub denumirea de MEDS (sindromul microcefalie, epilepsie și diabet). Până în prezent, doar două gene (IER3IP1 și YIPF5) fuseseră legate în mod definitiv de MEDS; noile rezultate stabilește TMEM167A ca a treia cauză genetică identificată. Identificarea unei noi gene implicate în acest sindrom rar oferă o clarificare importantă a etiologiei și extinde panoplia de gene ce trebuie căutate în protocoalele de screening genetic atunci când se confruntă cu diabet neonatal în fundalul unei tulburări neurologice.
Din perspectivă clinică și genetică, descoperirea atrage atenția asupra necesității testării genetice extinse la nou-născuții cu diabet care au semne neurologice asociate. Aceasta permite stabilirea unui diagnostic clar, orientarea managementului medical și oferirea de informații relevante pentru consilierea familială privind riscul recurent, opțiunile de testare prenatală și posibilele implicații pentru frați sau alte rude. În plus, caracterizarea moleculară a variantelor TMEM167A ajută la definirea fenotipurilor clinice și la recunoașterea tiparelor care pot ghida pediatrii și neonatologii către investigații genetice adecvate.
Cum subminează TMEM167A producția de insulină
Gena TMEM167A este activă atât în pancreas, cât și în creier, la oameni și la șoareci — un tipar de expresie care explică de ce mutațiile afectează ambele organe. Pentru a studia efectele variantei identificate, cercetătorii au editat celule stem pluripotente umane, înlocuind gena TMEM167A normală cu varianta găsită la un pacient cu MEDS. Aceste celule stem au fost apoi direcționate să se diferențieze în celule beta pancreatice, celule specializate care sintetizează și eliberează insulină în răspuns la glucoză. Modelul experimental — utilizând celule stem pluripotente induse sau embryonare țintite prin editare genetică — oferă un cadru puternic pentru a observa efectele directe ale unei variante pe dezvoltare, funcție și supraviețuire celulară.
Pe lângă demonstrarea expresiei TMEM167A în țesuturi relevante, studiul a folosit instrumente moleculare pentru a evalua semnătura transcriptomică a celulelor modificate, răspunsul la stimulii metabolici și integritatea organitelor citoplasmatice implicate în ambalarea și secreția proteinelor. Aceste analize permit corelarea modificărilor genetice cu perturbări precise ale căilor celulare — de exemplu, asocierea directă cu semnale care indică stresul reticulului endoplasmatic, modificări ale procesării proinsulinei sau dereglări ale mecanismelor de control al calității proteinelor.
Dezvoltarea pare normală — funcția nu este
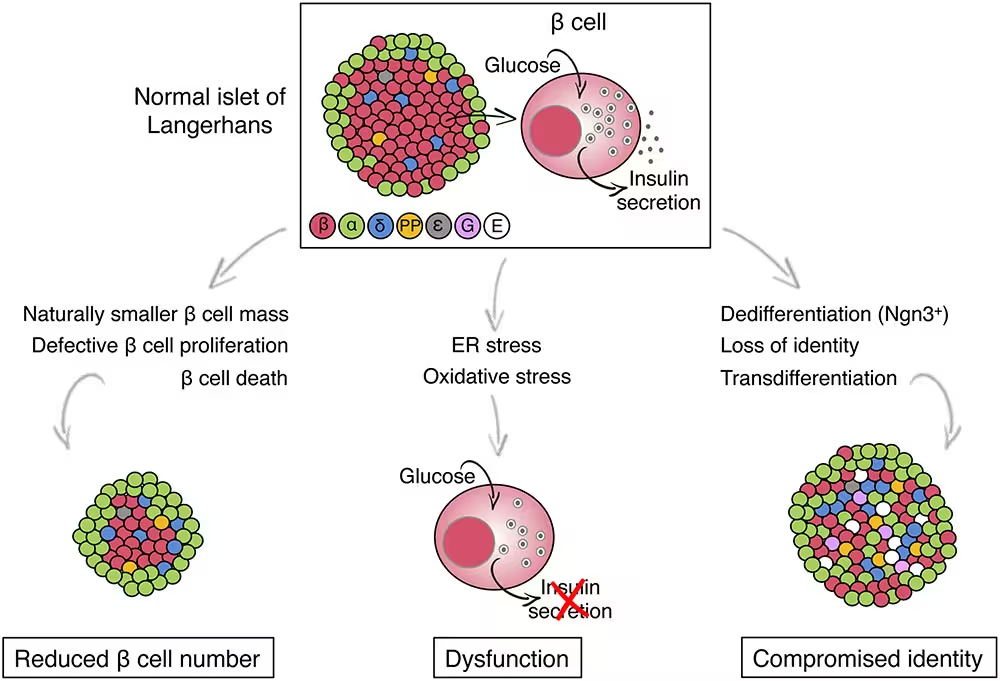
Spre surprinderea cercetătorilor, celulele beta care purtau varianta TMEM167A s-au format din punct de vedere morfologic și în număr comparabil cu celulele sănătoase, dar prezentau un defect funcțional evident. Când au fost stimulate cu glucoză, aceste celule nu au reușit să elibereze insulină în modul în care o fac celulele beta normale. Disfuncția a fost atribuită stresului în reticulul endoplasmatic (RE) — rețeaua celulară responsabilă pentru plierea proteinelor și traficul lor intracelular. Stresul RE cronic a activat căi de semnalizare cunoscute care, printr-o reacție în lanț, declanșează programul de răspuns la proteine nepliate (UPR) și, în cazuri prelungite, induce căi apoptotice care conduc la pierderea efectivă a celulelor beta.
În detaliu, răspunsul UPR include activarea senzorilor precum PERK, IRE1 și ATF6, care încearcă inițial să restabilească homeostaza proteică prin reducerea încărcăturii secretorii și creșterea capacității de replieri și degradare a proteinelor. Cu toate acestea, dacă această stare de dezechilibru se menține, intracelulele declanșează căi care promovează oprirea sintezei proteice și expresia factorilor stresului care pot favoriza moartea celulară programată. În contextul TMEM167A, consecința este o combinație de eșec al secretării insulinei și scădere progresivă a populației de celule beta, fenomene relevante nu doar pentru forme rare de diabet, ci și pentru înțelegerea mecanismelor de epuizare a celulelor beta în diabetul zaharat tip 2.
„Capacitatea de a genera celule producătoare de insulină din celule stem ne-a permis să studiem ce este disfuncțional la celulele beta ale pacienților cu forme rare, dar și cu alte tipuri de diabet,” a explicat diabetologul Miriam Cnop de la Vrije Universiteit Brussels (Free University of Brussels). „Acesta este un model extraordinar pentru studiul mecanismelor bolii și testarea tratamentelor.” Observația subliniază valoarea modelului de celule stem în cercetarea diabetului: permite atât analiza mecanistică detaliată, cât și testarea de compuși candidate pentru restabilirea funcției secretorii sau pentru ameliorarea stresului reticulului endoplasmatic.
Utilizarea acestor modele farmaceutice in vitro poate accelera identificarea de agenți terapeutici cu potențial clinic, cum ar fi chaperone moleculare (de exemplu, 4-phenylbutyrate sau tauro-ursodeoxycholic acid în studii preclinice), inhibitori selectivi ai căilor UPR sau modulatori ai homeostaziei calciului și a traficului vesicular. Deși multe dintre aceste abordări sunt încă într-o fază exploratorie, platformele derivate din celule stem permit cribrări de mare volum (high-throughput screening) pentru compuși care reduc stresul RE sau stimulează eliberarea insulinei fără a compromite supraviețuirea celulară.
De ce contează dincolo de boala rară
Deși MEDS este extrem de rar (doar aproximativ 11 cazuri înregistrate înainte acestui studiu), problemele la nivel celular — stresul RE, secreția insuficientă de insulină și pierderea celulelor beta — oglindesc procese întâlnite în formele comune de diabet, cum ar fi diabetul zaharat tip 2. Această suprapunere în mecanisme sugerează că studiul TMEM167A poate furniza informații valoroase pentru cercetarea mai largă a diabetului: de la identificarea unor ținte terapeutice noi până la optimizarea strategiilor de înlocuire a celulelor beta bazate pe celule stem. În esență, genele descoperite prin studiul formelor monogenice rare pot funcționa ca ferestre către mecanisme critice pe care le împărtășesc și fenotipuri mult mai frecvente.
În plus, descoperirea evidențiază importanța integrării datelor de exprimare genică, a modelelor animale și a sistemelor umane derivate din celule stem pentru a valida relevanța clinică a descoperirilor moleculare. Conexiunea între mutațiile TMEM167A și fenotipul MEDS oferă un exemplu de „deconvoluție” a relației gen-fenotip, în care o variantă genetică punctuală sau o deleție poate oferi indicii directe despre pași critici în biosinteza și secreția insulinei.
„Găsirea modificărilor în ADN care provoacă diabet la sugari ne oferă o cale unică de a identifica genele care joacă roluri cheie în producerea și secreția insulinei,” a declarat geneticianul molecular Elisa de Franco de la University of Exeter. „Munca noastră clarifică modul în care o genă puțin cunoscută, TMEM167A, este esențială pentru secreția de insulină.” Afirmarea subliniază potențialul translational al studierii acestor gene: validarea unor ținte moleculare pentru intervenții farmacologice sau opțiuni de terapie genică la viitor.
Privind înainte: diagnostic și potențiale terapii
Din punct de vedere clinic, recunoașterea mutațiilor TMEM167A permite diagnosticul genetic definitiv al cazurilor de MEDS, ceea ce poate ghida consilierea familială, deciziile privind managementul neonatal și îngrijirea pe termen lung a copiilor afectați. Testarea genetică timpurie poate influența modul de monitorizare, instaurarea timpurie a terapiei insulinice și planificarea intervențiilor neuropsihologice pentru afecțiuni asociate precum epilepsia sau întârzierile de dezvoltare. Pe frontul cercetării, modelul pe bază de celule stem oferă o platformă pentru testarea unor compuși care ar putea reduce stresul RE sau consolida secreția de insulină, precum și pentru evaluarea strategiilor de gene-therapy sau de corecție genetică în celule derivabile pentru transplant.
Progresele în tehnologii precum CRISPR/Cas9 permit corecția precisă a variantelor patogene în celule stem pluripotente, deschizând posibilitatea abordărilor de medicină regenerativă sau a testelor preclinice pentru transplant autolog de celule beta corectate. Totuși, trebuie subliniat că tranziția de la descoperirea genetică la terapii clinice efective este complexă și poate dura ani. Obstacolele includ asigurarea siguranței pe termen lung a celulelor modificate, obținerea unei secreții de insulină reglabile și prevenirea răspunsurilor imunologice adverse.
Pe termen scurt și mediu, rezultatele permit o îmbunătățire a protocoalelor de diagnostic genetic și oferă ținte clare pentru eforturi de drug discovery orientate spre ameliorarea stresului reticulului endoplasmatic sau îmbunătățirea traficului și procesării proteinelor secretorii în celulele beta. În plus, acumularea de date despre genele implicate în MEDS poate sprijini dezvoltarea unor ghiduri clinice specifice pentru managementul pacientului, abordări multidisciplinare care integrează diabetologia pediatrică, neurologia și consilierea genetică pentru a asigura cea mai bună îngrijire posibilă a sugarilor și copiilor afectați.
Sursa: sciencealert

Lasă un Comentariu