8 Minute
Prezentare generală a studiului și imagine cheie
Un studiu nou realizat la Florey Institute of Neuroscience and Mental Health din Melbourne raportează că infectarea cu COVID-19 a masculilor de șoareci a produs modificări măsurabile în materialul spermatic care au fost asociate cu un comportament de tip anxios mai accentuat la descendenți. Rezultatele, evaluate în revizuire colegială și publicate în Nature Communications, indică alterări moleculare ale ARN-ului spermatic și modificări persistente ale activității genelor cerebrale care ar putea reflecta moștenirea epigenetică.
Conform autorilor, aceste schimbări moleculare nu sunt limitate la variații întâmplătoare, ci afectează specii de ARN care sunt recunoscute pentru rolul lor în reglarea rețelelor genetice implicate în dezvoltarea neurală. Acest lucru susține ipoteza că expunerea paternă la un agent infecțios precum SARS-CoV-2 poate influența indirect dezvoltarea neurologică a urmașilor prin semnale moleculare transmise prin spermă.
Studiul adaugă date experimentale importante la literatura emergentă privind modul în care factori de mediu — inclusiv infecțiile virale — pot modifica constituentul molecular al gameților și pot influența fenotipurile descendenților. Deși cercetarea se bazează pe un model murin, calitatea metodologică, controlul experimental și publicarea în jurnal peer‑reviewed sporesc valoarea științifică a concluziilor, oferind date tangibile pentru ipoteze privind moștenirea epigenetică asociată cu COVID-19.
Detalii experimentale și descoperiri moleculare
În designul experimental, cercetătorii au expus masculi adulți de șoareci la virusul care cauzează COVID-19, au împerecheat acești masculi cu femele neinfectate și au monitorizat cu atenție sănătatea, comportamentul și expresia genică cerebrală a numerelor rezultate. Echipa a folosit protocoale standardizate pentru manipularea animalelor, controale adecvate și timp de recuperare înainte de împerechere pentru a separa efectele acute ale îmbolnăvirii de cele care persistă la nivel germinal.
Toți urmașii concepuți de tați anterior infectați au prezentat, în teste comportamentale standard folosite pentru evaluarea anxietății la rozătoare, un profil cu manifestări de tip anxios mai pronunțate comparativ cu urmașii proveniți de la tați neinfectați. Observațiile comportamentale au fost susținute de analize moleculare care au identificat modificări specifice ale moleculelor de ARN din spermă după infecție. Aceste alterări au inclus clase de ARN cunoscute pentru capacitatea lor de a regla transcriptomul embrionar timpuriu și rețelele genetice ale neurodezvoltării, cum ar fi microARN-urile și fragmentele derivate din tRNA (tRF).
Autorii raportează, de asemenea, că unele dintre aceste molecule de ARN purtate de spermă sunt implicate în reglarea genelor active în etapele timpurii ale formării creierului, sugerând un mecanism prin care semnalele paterne pot modula programul dezvoltării neurobiologice. Aceasta include posibile influențe asupra căilor de semnalizare sinaptică, plasticității neuronale și reglării stresului, toate relevante pentru fenotipurile de anxietate observate ulterior.
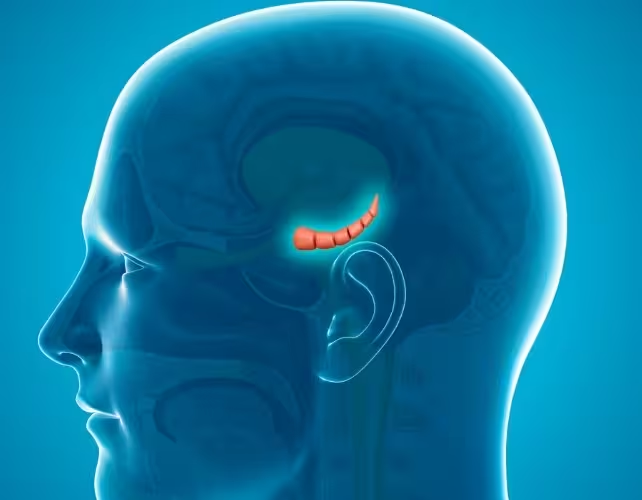
Hipocampul (centrul) într-un creier uman
La nivelul descendenților de sex feminin, echipa a observat „schimbări semnificative” în tiparele de expresie genică din hipocamp — o regiune cerebrală centrală pentru reglarea emoțiilor și procesarea memoriei. Carolina Gubert, co‑autor senior, a sintetizat interpretarea: „Aceasta poate contribui la anxietatea crescută pe care am observat‑o la urmași, prin moștenire epigenetică și dezvoltare cerebrală alterată.” Rezultatele sugerează că modificările induse de experiența imunitară paternă pot reverbera asupra transcriptomului cerebral al urmașilor, cu potențial impact funcțional.
Conducătorul studiului, Anthony Hannan, a subliniat implicațiile posibile mai largi: „Aceste constatări sugerează că pandemia de COVID-19 ar putea avea efecte de durată asupra generațiilor viitoare.” Totuși, cercetătorul a atras atenția asupra necesității unor investigații suplimentare pentru a stabili dacă aceleași mecanisme sunt valide la oameni, în contextul diferențelor fundamentale dintre biologia germinală și dezvoltarea umană comparativ cu modelele murine.
Context științific și implicații
Mecanismul denumit moștenire epigenetică se referă la modificări care nu implică schimbări în succesiunea bazelor ADN, ci incluziuni chimice sau variații în conținutul de ARN din celulele germinale care pot influența expresia genelor la descendenți. Exemple tipice includ metilarea ADN-ului, modificări ale histonelor și transferul de ARN non‑codant prin spermă. Studiile în modele animale au demonstrat anterior că factori de mediu — precum stresul, dieta sau expunerea la toxine și infecții — pot modifica aceste marcaje epigenetice și pot conduce la variații fenotipice la urmași.
Rezultatele curente extind această literatură prin includerea infecției cu SARS‑CoV‑2 în listă, cel puțin într‑un model murin controlat. Dacă procese similare ar apărea și la oameni, implicațiile pentru sănătatea publică ar putea fi semnificative: milioane de persoane au fost infectate în timpul pandemiei, iar efectele transgeneraționale ar extinde amprenta biologică a pandemiei dincolo de populația afectată direct. Totuși, autorii studiului și experți externi avertizează împotriva extrapolării directe: biologia germinală umană și procesele de dezvoltare prenatală diferă în mod important de cele ale șoarecilor, iar dovezile epidemiologice care leagă infecția parentală cu COVID‑19 de modificări neurodezvoltative la copii nu sunt încă stabilite.
În evaluarea riscului populațional, trebuie luate în calcul factori confounderi, inclusiv starea de sănătate preexistentă a părinților, condițiile socio‑economice, accesul la îngrijirea prenatală și expuneri adiționale pe durata sarcinii și dezvoltării timpurii. În plus, efectele epigenetice observate în laborator pot fi modulate sau atenuate de mediul postnatal, intervenții timpurii și plasticitatea dezvoltării neurale.
Pași următori și priorități de cercetare
Direcțiile viitoare de cercetare recomandate includ investigarea dacă modificări comparabile ale ARN‑ului spermatic și ale marcajelor epigenetice apar la bărbații infectați cu SARS‑CoV‑2, dacă aceste semnale persistă pe termen lung în gama germinală și cum interacționează cu factorii materni și mediul postnatal. Studii cohortale longitudinale care urmăresc bărbați infectați înainte de concepție, împreună cu analize moleculare ale spermatozoizilor și evaluări neurodezvoltative ale copiilor, ar putea oferi dovezi epidemiologice complementare studiilor mecanistice de laborator.
Pe plan experimental, este necesară clarificarea mecanismelor moleculare: determinarea speciilor exacte de ARN implicate, identificarea căilor genomice țintă în embrion și evaluarea modului în care aceste semnale influențează epigenomul în celulele timpurii ale creierului. Experimente de „rescue” sau de transfer molecular (de exemplu, microinjecții de fracții de ARN din spermă în zigoti) pot testa causalitatea și pot delimita ce componente moleculare sunt necesare și suficiente pentru a reproduce fenotipurile comportamentale observate.
De asemenea, cercetările ar trebui să exploreze posibile măsuri de atenuare: există intervenții prenatale sau periconcepționale care pot reduce riscul de transmitere epigenetică? Care este fereastra temporală de vulnerabilitate a gameților? Răspunsurile la aceste întrebări pot avea implicații pentru recomandări clinice privind consilierea reproductivă, vaccinarea și politicile de sănătate publică în perioade de pandemie.
Concluzie
Studiul realizat la Melbourne furnizează dovezi experimentale în model de șoarece că infecția paternă cu SARS‑CoV‑2 poate modifica conținutul molecular al spermatozoizilor și poate coincide cu modificări legate de anxietate în funcția și comportamentul cerebral al urmașilor. Aceste constatări ridică întrebări importante despre posibilele efecte transgeneraționale ale bolilor infecțioase și subliniază necesitatea unor investigații riguroase, multidisciplinare, care să includă cercetare moleculară, studii pe populații și considerente etice.
În final, traducerea acestor rezultate dintr‑un model animal în recomandări clinice sau politici de sănătate pentru oameni necesită dovezi suplimentare: studii la om care să confirme apariția modificărilor epigenetice relevante în spermă, să evalueze persistența lor și să le coreleze cu consecințe neurodezvoltative la copii. Până atunci, concluziile oferă un cadru conceptual util și o direcție clară pentru cercetările viitoare în domeniul epigeneticii, neurobiologiei dezvoltării și sănătății publice.
Sursa: sciencealert

Lasă un Comentariu